
Klinisk utveckling
Följ framstegen och den fortsatta utvecklingen av linaprazan glurate
Klinisk utveckling
Den pågående kliniska utvecklingen och testningen av linaprazan glurate visar lovande resultat när det gäller syrakontroll och sänkning av Cmax-värdet* vilket minskar belastningen på levern. Följ framstegen och den fortsatta utvecklingen här.
Fas II-studien inleddes under Q3 2021, inom ramen för ett riskreducerat kliniskt utvecklingsprogram, baserad på resultat från fas I studier och erfarenheter från tidigare försök med den aktiva metaboliten linaprazan. Tydliga biomarkörer baserade på publicerade data samt resultaten från de genomförda fas I studierna minskar den kommande utvecklingsrisken. Dessa biomarkörer applicerades i designen av fas II studien med huvudsyftet att optimera precisionen i dosvalet för de kommande fas III-studierna. LEED fas II-studien avslutades Q4 2022 och "för patienter med måttlig till svår eGERD, LA-gradering C/D, var den högsta läkningsgraden efter fyra veckor för en dosgrupp med linaprazan glurate 89%, jämfört med 38% i gruppen som behandlades med lansoprazol."
Kliniska tester av linaprazan glurate – fas I till fas III
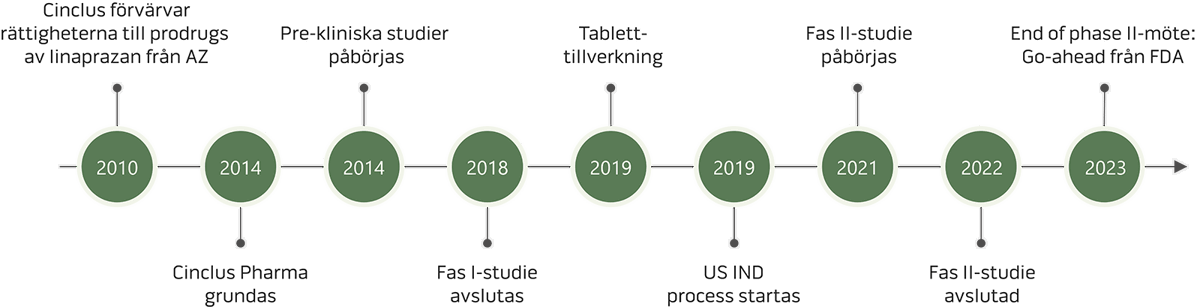
Fas I
Fas I inleddes i februari 2017 och rekryteringen av försökspersoner till "first-in-human study" avslutades under fjärde kvartalet 2017. Tre kliniska fas I-studier är avslutade. Ytterligare fas I studier pågår och är planerade. Alla genomförda studier visade att linaprazan glurate är säkert och väl tolererat.
Fas II
Fas II-studien initierades under andra halvan av 2021 som en del av ett riskreducerat kliniskt utvecklingsprogram, baserat på erfarenheter från tidigare försök med den aktiva metaboliten linaprazan och avslutades Q4 2022 med positiva resultat. Ändamålet med studien var att stödja valet av den optimala dosen för fas III-studierna, baserat på dosberoende läkningsfrekvens av erosiv esofagit.
Programmet baseras på:
-
Tidigare studier som exponerade ~2 600 försökspersoner för den aktiva metaboliten av linaprazan glurate
-
Tillgång till tydliga biomarkörer
-
Stark korrelation mellan plasmakoncentration och pH-kontroll
Fas III
Under fjärde kvartalet 2023 hade Cinclus Pharma ett framgångsrikt rådgivande möte, ett så kallat end-of-phase-II-möte, med det amerikanska läkemedelsverket, FDA, som i stora drag accepterade bolagets förslag på fas III-program, inklusive studiedesign och primära slutmål för studierna. Det positiva utfallet gör att Cinclus Pharma nu arbetar för att starta fas III-programmet.
Studier som utförts på linaprazan (den huvudsakliga metaboliten)
Omfattande data från 23 fas I-studier som exponerade mer än 600 försökspersoner och två fas II-studier som exponerade cirka 2 000 patienter för den aktiva metaboliten visar att linaprazan tolererades väl, hade ett snabbt insättande och full effekt vid första dosen. Linprazan är den aktiva metaboliten av linaprazan glurate.
Fas I – tre studier avslutade
Dosrelaterad pH-kontroll och en tydlig biomarkör är signifikanta resultat från de avslutade fas I-studierna.
Dosberoende pH-kontroll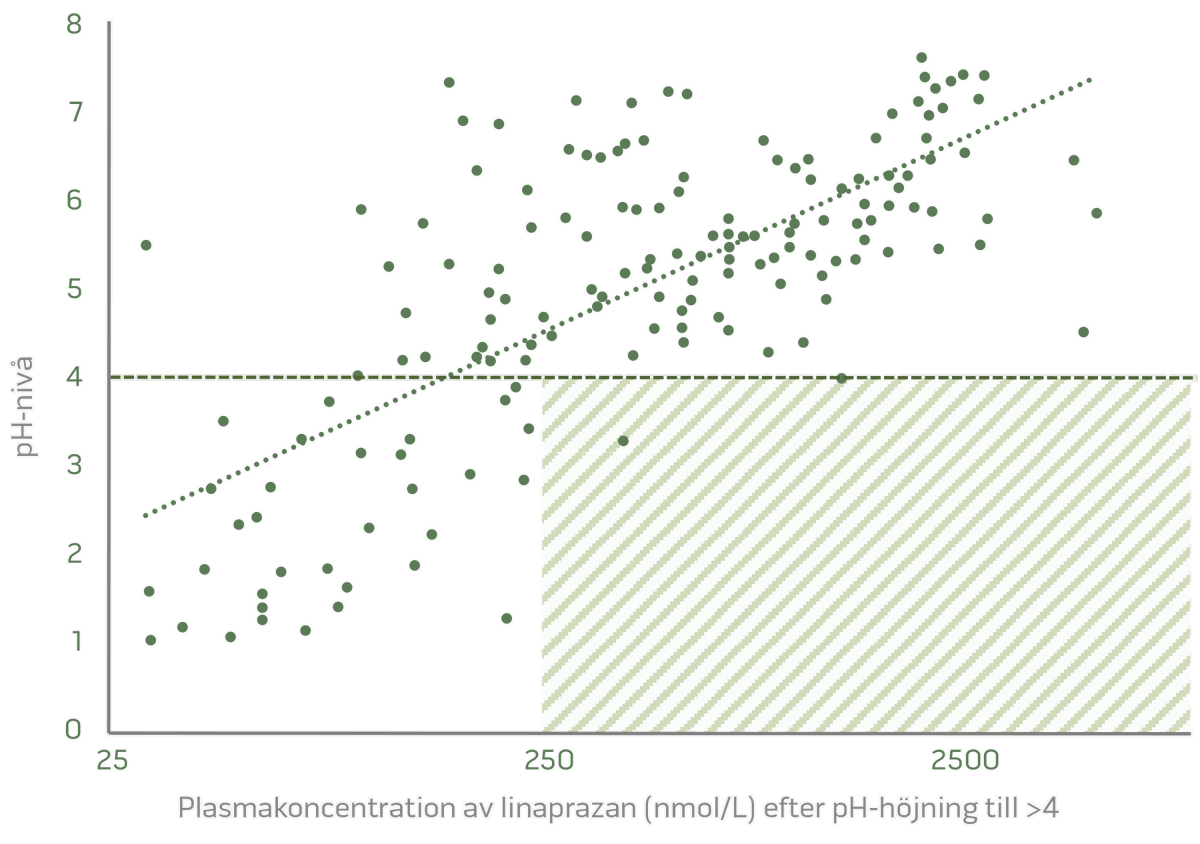
Linaprazan glurate – Flytande beredning
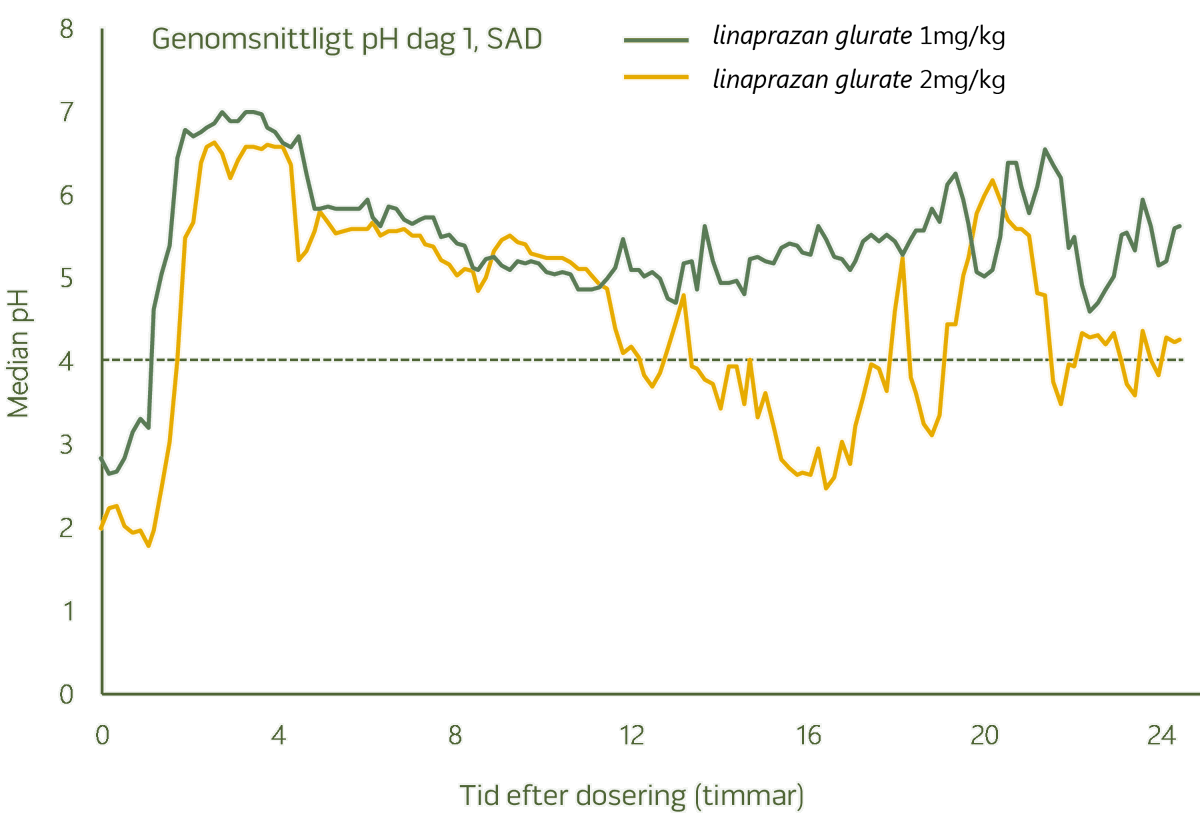
Översikt över SAD/MAD-studien
Studie av ökande singeldos (single ascending dose, SAD) och ökande multipel dos (multiple ascending dose, MAD) utförd i Sverige.
Huvudsyfte och resultat
Linaprazan glurate var säker och vältolererad. Inga allvarliga biverkningar (serious adverse event, SAE) uppstod efter dosering.
-
Dosrelaterad farmakokinetik
-
Dosrelaterad syrahämning och tydligt PK/PD-förhållande
-
Ingen effekt av födointag upptäcktes
-
Studiens definierade maximala dos uppnåddes
-
Vid högre dosnivåer bibehölls hämningen av magsyra under 24 timmar
Beskrivning
-
Enstaka och flera ökande doser
-
Flytande beredning
-
Första studien i människa
-
Medicinskt ID-nummer: NCT03105376
Utvärderingsparameter
-
Frekvens av oönskade effekter, laboratorieresultat och vitalparametrar
-
Standardiserade PK-parametrar
-
Dosbegränsande toxicitet
-
Förhållandet mellan PK/PD-parametrar där PD är intragastriskt pH under 24 timmar
Antal patienter
-
Totalt doserades 28 försökspersoner, varav 9 försökspersoner doserades mer än en gång
-
Genomförd av CTC Clinical Trial Consultants i Uppsala
Tidsplan
Inleddes i februari 2017. Final studierapport i februari 2018.
Fas II-studien leed
I november 2022 meddelade Cinclus Pharma positiva topline-resultat från fas II-studien, LEED (Linaprazan glurate Erosive Esophagitis Dose Ranging).
LEED-studien var en randomiserad, dubbelblind studie utförd i USA och Europa på patienter med erosiv esofagit (eGERD). Patienterna delades in i två kohorter, en med patienter med måttlig till svår eGERD (Los Angeles (LA) gradering C eller D) och en med patienter med mildare eGERD (LA-grad A eller B) och tidigare historik av minst åtta veckor med protonpumpshämmare (PPI).
Studiens primära mål var att stödja valet av dos av linaprazan glurate för fas III-programmet i eGERD, bedömd som endoskopisk läkning av eGERD efter fyra veckors behandling, med säkerhet och tolerabilitet som sekundära mål. Antalet patienter som behövdes för att mäta effekt baserades på patientkohorten med måttlig till svår eGERD.
Totalt randomiserades 248 patienter till fyra veckors dubbelblind behandling med antingen en av de fyra doserna av linaprazan glurate eller den aktiva jämförelsesubstansen lansoprazol, en PPI i den godkända standarddosen för eGERD-läkning, följt av fyra veckors öppen behandling med lansoprazol i godkänd standarddos för eGERD-läkning. Läkning definierades som ingen erosion på esofagus, dvs. inga frätskador på matstrupens slemhinna.
En retrospektiv central granskning av endoskopifynd utfördes efter fyra veckor och 162 patienter med eGERD var tillgängliga för utvärdering av studiens primära mål. Alla inkluderade 248 patienter inkluderades i säkerhetsanalysen.
För patienter med måttlig till svår eGERD, LA-grad C eller D, var den högsta läkningsgraden efter fyra veckor i en dosgrupp med linaprazan glurate 89%, jämfört med 38% i lansoprazol-gruppen. Även om studien inte var designad för att visa signifikans mot jämförelsesubstansen lansoprazol, var den genomsnittliga läkningsgraden hos alla C- och D-patienter som behandlades med linaprazan glurate signifikant högre än läkningsgraden i lansoprazol-gruppen i en konservativ post-hoc-analys (Fishers exakta test, genomsnittligt harmoniskt p-värde <0,05).
För alla patienter som behandlades med linaprazan glurate var den genomsnittliga läkningsgraden 80% jämfört med 69% i lansoprazol-gruppen. För patienter med mildare eGERD, LA-grad A eller B var den högsta läkningsgraden efter fyra veckor för en dosgrupp med linaprazan glurate 91%, jämfört med 81% i lansoprazol-gruppen. Linaprazan glurate tolererades i allmänhet väl och säkerhetsdata var jämförbara med lansoprazols. Den mest rapporterade biverkningen var covid-19 som inträffade hos 4% av den totala studiepopulationen.


